-
互联网医院
-
办公OA
-
支付宝生活号
-
微信服务号
-
微信订阅号
-
药物临床试验伦理委员会隶属滁州市第一人民医院。对涉及人的生物医学研究项目的科学性和伦理合理性进行独立、称职和及时的审查。审查范围包括药物临床试验项目、医疗器械临床试验项目、涉及人的临床科研项目。审查类别包括初始审查、跟踪审查和复审。通过对临床研究项目的科学性、伦理合理性进行审查,确保受试者尊严、安全和权益得到保护。伦理委员会下设办公室。伦理委员会办公室负责伦理委员会日常行政事务的管理工作。
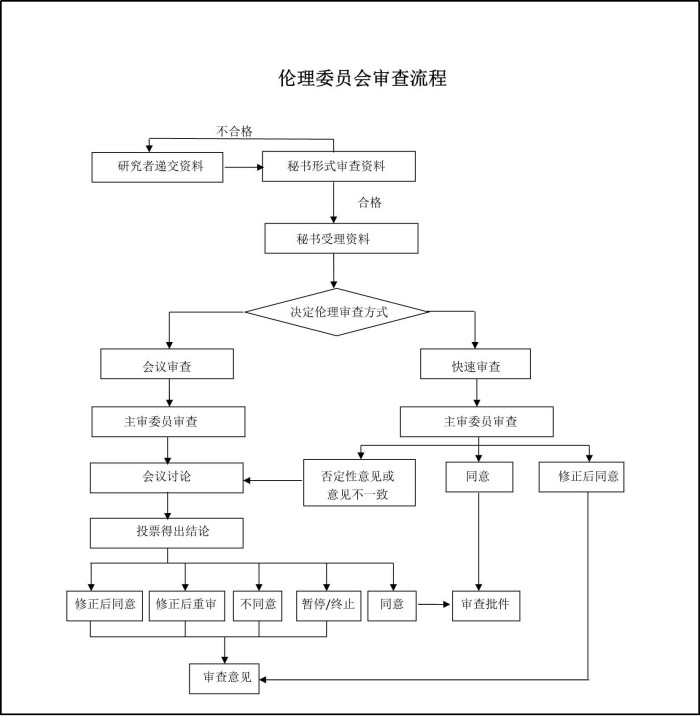
图1 药物临床试验伦理审查流程
为保护临床研究受试者的权益和安全,根据国家食品药品监督管理总局《药物临床试验质量管理规范》(2020年),《药物临床试验伦理审查工作指导原则》(2010年)、《涉及人的生物医学研究伦理审查办法》(2016年)、《医疗器械监督管理条例》(中华人民共和国国务院令,2021)、《涉及人的生物医学研究伦理审查办法》(国家卫生和计划生育委员会,2016)等相关法律法规的要求,我院组建了药物临床试验伦理委员会,由17位不同性别、不同职业背景的委员组成,其中包括医院管理人员、临床医师、药学专业人员等。既有非医学专业的人员,也有院外人士参加,其构成情况符合相关法规的要求。
办公室地点:滁州市第一人民医院北区药物临床试验中心伦理办公室;
联系电话:0550-3523215;18155055855(伦理秘书 王娜);
传真:0550-3523215。
附件:GCP伦理相关表格模版
返回顶部





